2023浙江省杭州第二中学统测模拟考化学试题
![]() 浙江省杭州第二中学高三统测模拟考化学试题
浙江省杭州第二中学高三统测模拟考化学试题
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 I 127 Ba 137
选择题部分
一、选择题(本大题共 25 小题,每小题 2 分,共 50 分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1. 已知 H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列说法正确的是
A. H3PO2属于二元酸 B. H3PO2属于三元酸
C. NaH2PO2属于酸式盐 D. NaH2PO2属于正盐
2. 下列仪器中名称正确且应放在石棉网上加热的是( )
A. ![]() 表面皿 B.
表面皿 B.  坩埚 C.
坩埚 C. 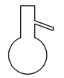 蒸馏烧瓶 D.
蒸馏烧瓶 D. ![]() 容量瓶
容量瓶
3. 下列反应与 Br2+SO2+2H2O=H2SO4+2HBr 相比较,水的作用不相同的是
A. 2Na2O2+2H2O=4NaOH+O2↑ B. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 3NO2+H2O=2HNO3+NO D. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
4. 下列说法不正确的是
A. 冰醋酸和水银都是纯净物 B. 氢原子和重氢原子是两种不同核素
C. 氯化钠固体和液氨都是电解质 D. 稀硫酸和氢氧化铜悬浊液都属于分散系
5. 下列常见物质的俗名或主要成份与化学式或结构简式相对应的是
A. 苏打——NaHCO3 B. 生石膏——2CaSO4·H2O C. 重晶石——BaCO3 D. 石炭酸—— ![]() OH
OH
6. 下列化学用语正确的是
A. 聚丙烯的结构简式:![]()
B. 丙烷分子的比例模型:
C. 甲醛分子的电子式:![]()
D. 2-乙基-1,3-丁二烯分子的键线式:![]()
7. 下列有关表述中正确的一组是
A. 过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)互为同分异构体
B. ![]() 和
和![]() 互为同系物
互为同系物
C. 16O2与18O2互为同位素
D. H![]() O、D
O、D![]() O、H
O、H![]() O、D
O、D![]() O 互为同素异形体
O 互为同素异形体
8. 证据推理与模型认知是化学学科的核心素养之一。下列事实与相应定律或原理不相符的是( )
A. 向Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深——勒夏特列原理
B. 常温常压下,1体积CH4完全燃烧消耗2体积O2——阿伏加德罗定律
C. 向漂白液中加入少量稀硫酸能增强漂白液的漂白效果——元素周期律
D. 通过测量C、CO的燃烧热来间接计算2C(s)+O2(g)=2CO(g)的反应热——盖斯定律
9. 下列说法正确的是
A. 硫酸铜是可用于饮用水的消毒
B. 氯化亚铁溶液与铜反应可用于制作印刷电路板
C. SiO2 可用于制作光导纤维,也可以制成光电池
D. 纯碱可用于玻璃、肥皂、造纸、食品等工业
10. 下列关于有机物的说法不正确的是
A. 苯和乙烯均可以使溴水褪色,但褪色原理不同
B. 乙醇能发生取代反应、氧化反应、消去反应
C. 分子式为 C5H12 的有机物,同分异构体有 3 种
D. 在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
11. 下列实验有关操作正确的是
A. 只有有色离子的检验才能用纸层析法,否则无法看到色斑
B. 在制取“摩尔盐”的实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
C. 在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断火柴头中有氯离子的存在
D. 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用碳酸氢钠或饱和硼酸溶液洗,最后用水冲洗, 并视情况作进一步处理
12. 以下关于铝及其化合物性质的描述中不正确的是
A. 铝不易被空气腐蚀是因为不会与氧气发生反应
B. 铝热反应可用于焊接铁轨
C. 氢氧化铝是一种两性氢氧化物
D. 铝元素是地壳中含量最多的金属元素
13. 下列离子方程式正确的是
A. 碳酸氢钠溶液中加入氢氧化钠溶液:HCO![]() +OH-=CO2+H2O
+OH-=CO2+H2O
B. 向 Fe(OH)3 中加入氢碘酸溶液:Fe(OH)3+3H+= Fe3++3H2O
C. Na2S2O3 与稀 H2SO4 混合:S2O![]() +2H+= S↓+SO2↑+H2O
+2H+= S↓+SO2↑+H2O
D. 铜和浓硝酸反应:3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
14. 下列说法不正确的是
A. 除去油脂中的少量水分,既可以用无水硫酸钠也可以用碱石灰
B. 淀粉和纤维素在一定条件下都可转化为乙醇
C. 氨基酸之间能发生反应生成多肽,构成蛋白质
D. 蛋白质在加热、重金属盐等作用下会发生变性
15. Y 是合成药物查尔酮类抑制剂的中间体,可由 X 在一定条件下反应制得。下列叙述不正确的是

A. 该反应为取代反应
B. Y 能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
C. X 和 Y 均能发生银镜反应
D. 等物质的量的 X、Y 分别与 H2 反应,最多消耗 H2 的物质的量之比为 4∶5
16. 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是
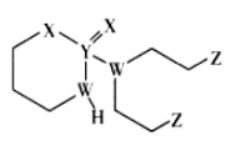
A. 元素的非金属性:W>Z>X
B. Y的最高价氧化物的水化物是强酸
C. W的最简单氢化物与Z的单质混合后可产生白烟
D. Y、Z形成的化合物中,每个原子均满足8电子结构
17. 某温度下,测得蒸馏水 pH=6,以下过程均在该温度下发生。下列说法中正确的是
A. 某溶液中水电离出的 c(H+)=1.0×10?12 mol· L?1,其 pH 一定是 12
B. 向氨水中通入 CO2,随着 CO2 的通入,![]() 不断增大
不断增大
C. 取 pH=5.5 的盐酸 100 mL,加水稀释到 1L,则溶液 pH 变为 6.5
D. pH 为 2 的 NaHSO4 与等体积 pH=10 的 NaOH 溶液充分反应后恰好呈中性
18. 锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是

A. 放电时,当电路中通过0.2mol电子的电量时,有0.2mol Li+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B. 通空气时,铜被腐蚀,表面产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D. 整个反应过程,空气中的O2起了催化剂的作用
19. 下列说法正确的是( )
A. MgF2中的两种离子核外排布相差一个电子层
B. 石英和硫磺晶体熔化时克服相同类型的微粒间作用力
C. 发生物理变化时物质中的化学键也可能被破坏
D. H2O和H2O2的稳定性不同是因为微粒间作用力不同
20. 设NA为阿伏加德罗常数的值,下列说法正确的是
A. pH=1的硫酸溶液1L,溶液中含SO![]() 的数目等于0.1NA
的数目等于0.1NA
B. 60gSiO2晶体中Si-O键数目为2NA
C. 10mL0.1mol/L的FeCl3与20mL0.1mol/LKI溶液反应,转移电子数为0.001NA
D. 真空密闭容器中充入0.1molH2和0.1molI2充分反应后,容器内分子总数为0.2NA
21. 已知:A(g)+3B(g)?2C(g)。起始反应物为A和B,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中C的物质的量分数如下表:下列说法不正确的是( )
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
40MPa | 0.549 | 0.429 | 0.322 | 0.169 |
A. 压强不变,降低温度,A的平衡转化率增大
B. 在不同温度下、压强下,平衡时C的物质的量分数可能相同
C. 达到平衡时,将C移出体系,正、逆反应速率均将减小
D. 为提高平衡时C的物质的量分数和缩短达到平衡的时间,可选择加入合适的催化剂
22. 卤化铵(NH4X)的能量关系如图所示,下列说法正确的是()

A. ΔH1>0,ΔH2<0 B. 相同条件下,NH4Cl的ΔH2比NH4I的小
C. 相同条件下,NH4Cl的ΔH3比NH4I的小 D. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
23. 常温下,向1 L 0.1 mol/L H2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是
![]()
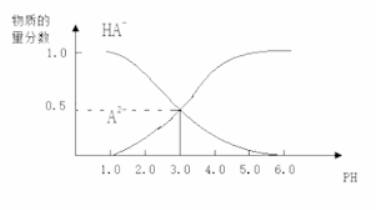
A. H2A的电离方程式为:H2A![]() H++HA- ,HA-
H++HA- ,HA-![]() H++A2-
H++A2-
B. 0.1 mol/L NaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. pH=4.0时,图中n(HA-)约为0.0091 mol
24. 实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe2(OH)n(SO4)3-0.5n]m和绿矾FeSO4·7H2O,其过程如图所示,下列说法不正确的是

A. 炉渣中FeS与硫酸、氧气反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S+6H2O
B. 溶液Z加热到70~80 ℃的目的是促进Fe3+的水解
C. 溶液Y经蒸发浓缩、冷却结晶、过滤等步骤可得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若pH偏小导致聚铁中铁的质量分数偏大
25. 某溶液可能含有下列离子的某几种:Cl-、I-、SO![]() 、CO
、CO![]() 、Na+、NH
、Na+、NH![]() 、Fe3+、Fe2+和Ba2+,且所含离子的浓度均相等。某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知,下列说法正确的是
、Fe3+、Fe2+和Ba2+,且所含离子的浓度均相等。某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知,下列说法正确的是
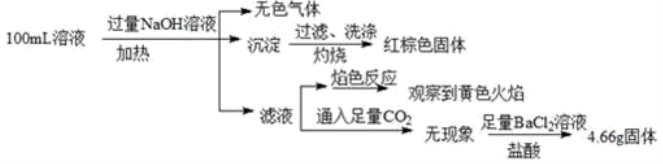
A. 原溶液中Fe3+和Fe2+可能都存在
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)=0.2mol/L
C. SO![]() 、NH
、NH![]() 、Fe2+一定存在,CO
、Fe2+一定存在,CO![]() 、Ba2+一定不存在
、Ba2+一定不存在
D. 若要进一步确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+
非选择题部分
二、非选择题(本大题共 6 小题,共 50 分)
26. (1)1mol 高聚物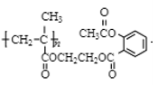 与足量NaOH溶液反应,最多可消耗NaOH_____mol
与足量NaOH溶液反应,最多可消耗NaOH_____mol
(2)酯可与水发生水解反应,也可以与醇发生跟水解反应类似![]() 醇解反应。请写出丙烯酸乙酯CH2=CHCOOCH2CH3 与 CH318OH 发生醇解的化学方程式_____
醇解反应。请写出丙烯酸乙酯CH2=CHCOOCH2CH3 与 CH318OH 发生醇解的化学方程式_____
27. (为测定无水Cu(NO3)2产品的纯度,可用分光光度法。已知:4NH3·H2O + Cu2+ = Cu(NH3)![]() +4H2O;Cu(NH3)
+4H2O;Cu(NH3)![]() 对特定波长光的吸收程度(用吸光度 A 表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)2+的吸光度A与Cu2+标准溶液浓度关系如图所示:
对特定波长光的吸收程度(用吸光度 A 表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)2+的吸光度A与Cu2+标准溶液浓度关系如图所示:
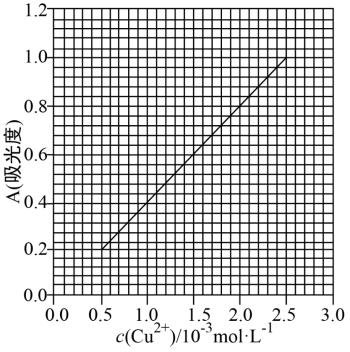
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度 A=0.620,则无水Cu(NO3)2产品的纯度是_____(以质量分数表示,保留三位有效数字),写出必要的过程。
28. 化合物 A 由三种短周期元素组成,某兴趣小组进行了如下实验:
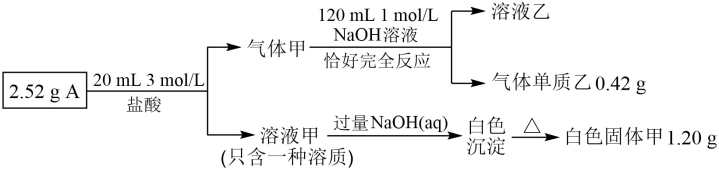
已知:气体甲为纯净物且只含两种元素,在标况下体积为 672 mL;固体甲为常用的耐火材料,溶液乙为建筑行业中常用的粘合剂。请回答下列问题:
(1)A 的组成元素为_____(用元素符号表示),A 的化学式为_____;
(2)写出气体甲与 NaOH(aq)反应![]() 离子方程式_____
离子方程式_____
(3)往溶液乙中通入少量 CO2气体发生的化学方程式_____;
(4)高温下A 与足量氯气能发生剧烈爆炸,生成三种常见化合物,试写出相应的化学方程式_____。
29. 乙炔是一种重要![]() 化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在 25℃、 101 kPa 时),CH4、C2H4在高温条件还会分解生成炭与氢气:
化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在 25℃、 101 kPa 时),CH4、C2H4在高温条件还会分解生成炭与氢气:
①C(s) +2H2(g)![]() CH4(g) ΔH1=-74.85kJ?mol-1
CH4(g) ΔH1=-74.85kJ?mol-1
②2CH4(g)![]() C2H4(g) +2H2(g) ΔH2=+340.93kJ?mol-1
C2H4(g) +2H2(g) ΔH2=+340.93kJ?mol-1
③C2H4(g)![]() C2H2(g) +H2(g) ΔH3=+35.50kJ?mol-1
C2H2(g) +H2(g) ΔH3=+35.50kJ?mol-1
请回答:
(1)依据上述反应,请写出 C 与 H2化合生成 C2H2的热化学方程式_____。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。图 1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是_____。
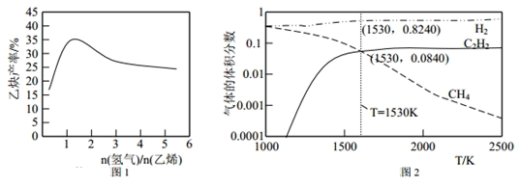
(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在 1530℃之前随温度升高而增大的原因可能是_____;1530℃之后,乙炔体积分数增加不明显的主要原因可能是_____。
②在体积为 1L 的密闭容器中反应,1530℃时测得气体的总物质的量为 1.000 mol,则反应 C2H4(g)![]() C2H2(g) +H2(g) 的平衡常数 K=_____。
C2H2(g) +H2(g) 的平衡常数 K=_____。
③请在图 3 中绘制乙烯的体积分数和反应温度的关系曲线______

30. 二草酸合铜( II )酸钾晶体{K2[Cu(C2O4)2]· 2H2O},微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。
(Ⅰ)用氧化铜和草酸为原料制备二草酸合铜(II)酸钾晶体的流程如下:

已知:H2C2O4![]() CO↑+CO2↑+H2O。回答下列问题:
CO↑+CO2↑+H2O。回答下列问题:
(1)将 H2C2O4晶体加入去离子水中,微热,溶解过程中温度不能太高,原因是_____。
(2)将 CuO 与 KHC2O4![]() 混合液在 50°C 下充分反应,该反应的化学方程式为_____。
混合液在 50°C 下充分反应,该反应的化学方程式为_____。
(3)50 °C 时,加热至反应充分后的操作是_____(填字母)。
A 放于冰水中冷却后过滤 B 自然冷却后过滤 C 趁热过滤 D 蒸发浓缩、冷却后过滤
(Ⅱ)以CuSO4· 5H2O 晶体和 K2C2O4固体为原料制备二草酸合铜( II )酸钾晶体。
实验步骤:将 CuSO4· 5H2O 晶体和 K2C2O4固体分别用去离子水溶解后,将 K2C2O4溶液逐滴加入硫酸铜溶液中,有晶体析出后放在冰水中冷却,过滤,用酒精洗涤,在水浴锅上炒干。炒时不断搅拌,得到产品。
(4)用酒精而不用冷水洗涤的目的是_____
(Ⅲ)产品纯度的测定:准确称取制得的晶体试样 ag 溶于 NH3·H2O 中,并加水定容至 250mL,取试样溶液 25.00mL,再加入 10 mL 的稀硫酸,用 b mol· L-1的 KMnO4标准液滴定,消耗 KMnO4标准液 V mL。
(5)滴定时,下列滴定方式中,最合理的是_____(填字母)。 (夹持部分略去)
A  B
B  C
C 
(6)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果会_____(填“偏大”偏小”或“无影响”)。
31. 乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活性,是良好的心脑血管疾病的治疗药物。
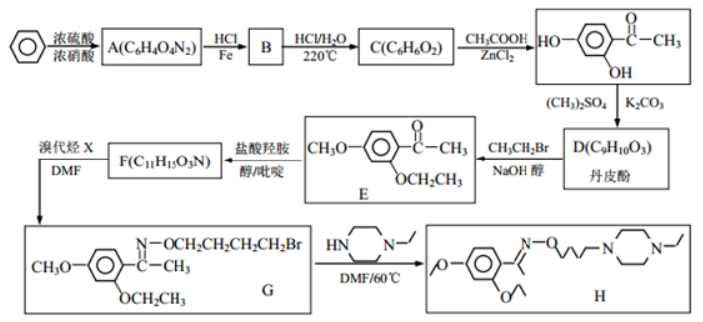
已知:①![]()
②![]()
③![]()
请回答:
(1)E 中含有![]() 官能团名称为_______
官能团名称为_______
(2)丹皮酚的结构简式为_____;
(3)下列说法不正确的是_______
A 乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3
B 物质B可能溶于水,且能与盐酸反应生成有机盐
C D→E 和 G→H 的反应类型均为取代反应
D 物质 C 能使浓溴水褪色,而且 1mol C 消耗 4molBr2
(4)写出 F→G 的化学方程式_____。
(5)写出满足下列条件 的所有同分异构体的结构简式_____。
的所有同分异构体的结构简式_____。
①含有六元含氮杂环;②无 N-N 键;③1H-NMR 谱显示分子中含有 4 种氢原子。
(6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合理的路线制备阿司匹林(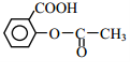 )。(用流程图表示,无机试剂任选)_____。
)。(用流程图表示,无机试剂任选)_____。

